En la antigüedad el uso de adhesivos o pegamentos ya se utilizaban en la época de las esculturas Egipcias, hace más de 3000 años y representaba piezas delgadas de chapa pegadas a tablas de sicomoro (árbol que crece en la zona tropical de Egipto) como así también adhesivos procedentes de la cocción de huesos de animales para unir laminas de madera.
Los romanos pegaban las partes de sus embarcaciones con cera de abeja o con brea obtenida de la madera de pino. Los aztecas preferían la mezcla de sangre y barro para unir piedras en la construcción de edificios. También las antiguas imprentas asiáticas utilizaban el almidón sobre el papel para que se pueda “pegar” la tinta. Por otro lado, los manuscritos medievales utilizaban la clara de huevo para pegar el papel.
En Gran Bretaña, en 1750 se patentó el primer pegamento de origen animal, la cola de pescado. Mucho tiempo después, en el Siglo XX, aparece por accidente el primer pegamento sintético, el cianocrilato, un pegamento muy poderoso que logro pegar dos cristales (el objeto y cubre objeto de una muestra para analizar en un microscopio) mientras el Dr. Harry Coover y su compañero Fred Joyner estaban experimentando con nuevos compuestos orgánicos. Sin dudar, vieron que el cianocrilato podría ser de gran utilidad y lo patentaron. A partir de 1958, el producto comenzó a comercializarse como pegamento fuerte, más conocido, hoy en día en nuestro país por la marca “la gotita”. En la actualidad, la medicina utilizan mucho estos adhesivos de cianocrilato para suturas de tejidos humanos, aunque no está aprobado para esa utilidad.
Pero, ¿cómo actúan los pegamentos? Un adhesivo o pegamento es una sustancia que, al aplicarse sobre la superficie de un sustrato, permite una unión resistente a la separación, deslizamiento y tensión. El sistema de unión, dependerá de la fuerza de enlace del adhesivo al sustrato a nivel microscópico y la fuerza interna del adhesivo o atracción.
Pero todo fenómeno de este tipo, tiene un fundamento y explicación química a nivel atómico y molecular, en las uniones químicas.
UNIONES QUÍMICAS
Los elementos químicos que se encuentran en la naturaleza, en su mayoría se hallan formando compuestos, combinados entre sí y muy pocos se encuentran solos, o en estado fundamental. Esto se debe a que en la naturaleza los átomos de los diferentes elementos se unen entre sí porque ganan estabilidad. La energía que contienen los compuestos es más pequeña que si se encontraran los átomos solos.
Como los átomos están formados por núcleos con carga positiva y electrones con carga negativa, las fuerzas electrostáticas son las responsables de mantener unidos a dos o más átomos.
Teoría del Octeto
En el año 1916, no fue fácil llegar a la conclusión y decir que la CEE de 8 electrones en el último nivel de energía es lo que le confiere estabilidad a los átomos. En ese tiempo Walter Kossel y el químico norteamericano Gilbert N. Lewis trataron de entender de forma independiente, como ocurrían los enlaces químicos.Para Kossel algunos átomos llegaban a esta situación si cedían o aceptaban electrones y se convertían en aniones o cationes. Así implantaban la unión química que hoy conocemos como enlace iónico. Lewis, en cambio, sostenía que los átomos que intervenían en una unión química lograban la máxima estabilidad cuando cada uno de ellos aporta un electrón, compartiendo el par formado. Esta fue la primera descripción del enlace covalente.
Además él creía que los electrones de la última capa se apareaban alrededor del núcleo para formar cuatro pares. Pero nunca utilizó el término octeto. Recién el químico estadounidense Irving Langmuir quien retomo sus trabajos, para ampliarlos aun más y formular lo que en la actualidad conocemos como la teoría del octeto.
Antes de continuar con los enlaces químicos propiamente dicho, continuaremos con, como y porque los átomos ceden o ganan electrones para adquirir estabilidad.
Los electrones del último nivel de energía de los átomos son los que participan en las reacciones químicas, es decir, los que están involucrados en las uniones químicas entre dos o más átomos. La relación que existe entre el número de protones nucleares y la configuración electrónica externa (CEE) en los elementos respectivos del segundo periodo de la tabla periódica.
En el Li, el electrón del último nivel de energía es atraído por tres protones; en el Be, cada electrón del último nivel energético es atraído por cuatro protones. Así sucesivamente, si vamos hacia el Ne, veremos que aumenta la atracción ejercida por el núcleo sobre los electrones del último nivel de energía. Dicho de otra manera, a medida que nos acercamos al Ne, los átomos de los elementos tendrán mayor dificultad para ceder electrones. Podemos deducir, que los átomos de los elementos representativos de los grupos 1, 2 y 13 presentan una marcada tendencia a ceder los electrones del último nivel de energía o electrones de valencia.
Cuando un átomo cualquiera cede estos electrones, adopta la CEE del gas noble que lo precede en la tabla periódica. Por ejemplo, el Na tiene tendencia a ceder un electrón y adoptar la CEE del Ne. En cambio, los átomos de los grupos 15, 16 y 17 tienden a aceptar electrones en su último nivel de energía para llegar al del gas noble más cercano, como el caso del Cl, tiende a tomar un electrón para llegar al del Ar.
El mecanismo de unión no se da de una sola forma, si no que pueden haber distintos casos de acuerdo a los entes químicos intervinientes. Pueden existir enlaces interatómicos (átomo-átomo) y enlaces intermoleculares (molécula-molécula). Estos también se pueden clasificar de acuerdo a la energía que contienen; hay enlaces más débiles y otros más fuertes. Los enlaces más fuertes son aquellos que ocurren entre átomos y los más débiles son aquellos entre moléculas. Veamos la clasificación general.
UNIONES INTERATÓMICAS
Las uniones mas fuertes son las que se dan entre átomos, principalmente de acuerdo a la diferencia de electronegatividad de los átomos intervinientes en la unión, estas pueden ser de tres tipos: El enlace iónico, que resulta de la interacción electrostática entre iones, que suele ser el resultado de la transferencia neta de uno o más electrones de un átomo o grupo de átomos a otro, el enlace metálico que se da solo entre los metales representativos y el enlace covalente, producto del compartimento de uno o más pares de electrones entre dos átomos. Pero veamos detalladamente cada uno de estos enlaces.
Enlace Covalente
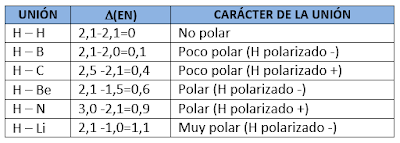
El enlace covalente se forma cuando dos átomos comparten uno o más pares de electrones y tiene lugar cuando la diferencia de electronegatividad, ▲(EN), entre los elementos (átomos) es cero o menor a 1,7.
En los compuestos predominantemente covalentes, los enlaces dentro de la molécula son fuertes, pero la fuerza entre estas moléculas de este tipo (intermoleculares) son débiles. Por lo tanto las propiedades físicas como puntos de fusión y ebullición son bajos en relación con los compuestos iónicos. Explicaremos esto con detalle en un cuadro comparativo para ver las grandes diferencias que hay entre los compuestos covalentes e iónicos al final.
Continuamos con la clasificación de los enlaces covalente, Según el aporte de electrones los enlaces covalentes pueden ser:
Enlace covalente normal: Cuando cada átomo aporta un electrón al par compartido.
Ej.: A – B
Enlace covalente coordinado o dativo: Similar al enlace covalente normal, pero con la diferencia de que dicha pareja de electrones que forma el enlace, es donada solamente por uno de los átomos combinados. El átomo que aporta el par de electrones se llama donante y el que recibe el par, aceptor.
Ej.: A→B
Según el número de pares de electrones compartidos:
a)- Covalente simple: dos átomos comparten un par de electrones;
b)- Covalente doble: dos átomos compartes dos pares de electrones;
c)- Covalente triple: dos átomos comparten tres pares de electrones.
Los enlaces covalentes de acuerdo a la polaridad del enlace pueden ser polares y no polares, que dependen de la diferencia de electronegatividad ▲(EN) que existe entre ellos.
Enlaces covalentes Polares y No Polares:
o Enlace No polar o Apolar: tal como el de la molécula de H2 (hidrogeno diatómico) el par de electrones es igualmente compartido entre los dos núcleos de hidrógeno. Ambos átomos de H tienen la misma electronegatividad, es decir que los electrones compartidos están igualmente atraídos por ambos núcleos de H. Esto es cierto para todas las moléculas diatómicas homonucleares, pero para átomos diferentes se considera no polar, si la ▲(EN) es £ 0,4. No hay diferencia en la polaridad. La r de ambas partes son iguales.
o Enlace polar: Se da cuando la nube electrónica se halla asimétricamente distribuida, la ▲(EN) va desde 0,4 a 1,7 se considera, covalente polar. Como por el caso del HCl.
Veamos algunos casos para ver como calcular y determinar cual es el tipo de unión entre los átomos y su polaridad.
Cuando hablamos de enlace iónico, nos hace relacionar rápidamente con la palabra ión, que es un átomo o grupo de átomos con carga eléctrica. Esto nos podría suponer deducir que este tipo de unión es entre iones de carga opuesta, ya que estos se van a atraer (cargas de diferente signo se atraen y de igual signo se rechazan).
Antes de continuar es necesario recordar los conceptos sobre lo que son las propiedades periódicas de energía de ionización, electronegatividad y afinidad electrónica.
El enlace iónico puede formarse con facilidad cuando los elementos que tienen baja electronegatividad y baja energía de ionización (metales) reaccionan con elementos que tienen alta electronegatividad y afinidad electrónica negativa (no metales).
La máxima diferencia de electronegatividad en un compuesto corresponde a la unión entre flúor F (elemento de electronegatividad más alta) y el cesio Cs (elemento de electronegatividad más baja):
La diferencia de electronegatividad ▲(EN) para estos dos se calcula de la siguiente manera:
Esto significa que los electrones de la última capa del cesio están muy atraídos hacia el átomo de flúor. Sin embargo la unión entre átomos del mismo elemento tendría una electronegatividad nula.
Enlace Metálico
Casi todos los metales forman estructuras solidas en las que los átomos están dispuestos como esferas empacadas de manera compacta. El número de electrones de la capa de valencia disponibles para la formación de enlaces es insuficiente para que un átomo forme un enlace de par electrónico con cada uno de sus vecinos. Para que cada átomo comparta sus electrones enlazantes con todos sus vecinos, estos electrones deben ser capaces de moverse de una región de enlace a la otra.
Una forma muy sencilla de explicar alguna de las características más importantes de los metales, es el modelo de mar de electrones. Es este modelo, el metal se representa como un conjunto de cationes metálicos en un “mar” de electrones de valencia.
Enlace Iónico
Antes de continuar es necesario recordar los conceptos sobre lo que son las propiedades periódicas de energía de ionización, electronegatividad y afinidad electrónica.
El enlace iónico puede formarse con facilidad cuando los elementos que tienen baja electronegatividad y baja energía de ionización (metales) reaccionan con elementos que tienen alta electronegatividad y afinidad electrónica negativa (no metales).
La máxima diferencia de electronegatividad en un compuesto corresponde a la unión entre flúor F (elemento de electronegatividad más alta) y el cesio Cs (elemento de electronegatividad más baja):
La diferencia de electronegatividad ▲(EN) para estos dos se calcula de la siguiente manera:
Esto significa que los electrones de la última capa del cesio están muy atraídos hacia el átomo de flúor. Sin embargo la unión entre átomos del mismo elemento tendría una electronegatividad nula.
Enlace Metálico
Casi todos los metales forman estructuras solidas en las que los átomos están dispuestos como esferas empacadas de manera compacta. El número de electrones de la capa de valencia disponibles para la formación de enlaces es insuficiente para que un átomo forme un enlace de par electrónico con cada uno de sus vecinos. Para que cada átomo comparta sus electrones enlazantes con todos sus vecinos, estos electrones deben ser capaces de moverse de una región de enlace a la otra.
Una forma muy sencilla de explicar alguna de las características más importantes de los metales, es el modelo de mar de electrones. Es este modelo, el metal se representa como un conjunto de cationes metálicos en un “mar” de electrones de valencia.
UNIONES INTERMOLECULARES
Además de las fuerzas que intervienen en la unión química entre los átomos, existen otras fuerzas de atracción que actúa entre todas las moléculas cuando estas se encuentran próximas. Estas se denominan uniones intermoleculares y son considerablemente más débiles que los enlaces iónicos, covalentes o metálicos. Las mismas fuerzas intermoleculares nombradas, son las que determinan si una sustancia en la naturaleza existe en forma gaseosa, líquida o sólida a una temperatura y presión determinada.
Las principales son las fuerzas de Van der Waals -en honor a su descubridor, el científico Johannes Diderick van der Waals- y las uniones de puente hidrogeno.
Fuerzas de Van der Waals
Estas fuerzas cumplen una función muy importante, que es determinar las propiedades físicas de las sustancias, como los puntos de fusión, puntos de ebullición, estados de agregación y la solubilidad. En realidad, las fuerzas de Van der Waals, es un conjunto de fuerzas que se dividen en tres, de acuerdo a su naturaleza:
Fuerzas dipolo-dipolo: Las moléculas polares se atraen entre sí porque tienen extremos con densidad de carga positiva (r+) y densidad de carga negativa (r-). Estas fuerzas existen entre las moléculas covalentes polares, debido a la atracción de las zonas de r+ de una molécula, por las zonas de r- de la otra. Estas fuerzas son efectivas solo si las moléculas están muy próximas entre sí.
Fuerzas de London o de dipolos transitorios: El continuo movimiento de sus nubes electrónicas provoca en las moléculas la aparición de dipolos indeterminados que cambian de manera constante en sentido y magnitud. Este fenómeno induce, a su vez, la formación de otro dipolo en una molécula vecina y así sucesivamente, lo que produce una atracción débil entre las diferentes moléculas. Los dipolos también se los conoce como fuerzas de London, en honor al físico alemán Fritz W. London.
Fuerzas ión-dipolo: Aunque no son estrictamente fuerzas intermoleculares, se las considera como fuerzas de Van der Waals. Se producen entre compuestos iónicos y moléculas covalentes polares. El polo con densidad de carga negativa (r-) de una molécula atrae al ión positivo o catión y el polo con densidad de carga positiva (r+) atrae al ión negativo o anión. Este fenómeno ocurre especialmente en las disoluciones de compuestos iónicos en solventes polares con el nombre de solvatación cuando el solvente es cualquier molécula polar. Se llama hidratación al mismo fenómeno, pero cuando el solvente es el agua.
Uniones de Puente hidrógeno
El enlace por puente hidrógeno se forma, cuando un átomo de hidrógeno unido a un elemento muy electronegativo por un enlace covalente (en una molécula polar) interacciona con un par electrónico no compartido de otro átomo, altamente electronegativo. Siempre que haya FON (flúor, oxígeno y nitrógeno) se establece un enlace de “puente” hidrógeno estable entre ambas moléculas.
El fluoruro de hidrógeno (HF) constituye un ejemplo importante de presencia de puentes hidrógeno. En este caso, debido a la naturaleza fuertemente electronegativa del F, los 6e- no compartidos pasaran la mayor parte del tiempo sobre el átomo de F, generando una alta r- y una alta r+ en el átomo de H.
En el caso del agua (H2O) la r+ está marcada en los extremos donde se ubica en H y la r- en el O que tiene 4e- no compartidos. También así, el amoniaco (NH3) que tiene 2e- no compartidos del O con r- y una r+ en los átomos de H, que harán puente con el O de otra molécula que este más próxima. A continuación se verá esquematizado lo dicho anteriormente más de cerca.




















No hay comentarios:
Publicar un comentario