"...La configuración electrónica es la forma en la que se distribuyen los electrones de un átomo en los diferentes niveles y orbitales..."
Para describir la distribución de los electrones entorno al núcleo se necesitan 4 números llamados cuánticos, que son: n, l, ml y s o ms.
Número cuántico principal (n)
Este es el nivel de energía, y corresponde al tamaño o volumen del átomo. Los niveles van de 1 a 7. Este nivel de energía aumenta con el valor de n, lo que significa que un electrón que se encuentre en el primer nivel de energía tiene menor energía que uno que esté en el tercero o cuarto nivel. Cuanto mayor el el valor de n, mayor es el volumen atómico, y los electrones que tenga se encontrarán más lejos del núcleo del átomo. En cuanto a la energía del electrón, este aumentará con el valor de n.
Número cuántico secundario o angular(l)
Este define la forma del orbital en el espacio de forma tridimensional (3D). Cada número cuántico angular corresponde a un subnivel de energía para los orbitales de un átomo, dichos subniveles son:
Orbitales de tipo s o sharp (nítido) de este existe de 1 tipo. Es de forma esférica
Orbitales de tipo p o principal (principal) de este existen de 3 tipos
Orbitales de tipo d o diffuse (difuso) de este existen de 5 tipos
Orbitales de tipo f o fundamental (fundamental) de este existen de 7 tipos
En cada orbital existe un máximo de 2 electrones, por lo que corresponde decir que:
-En el orbital s se pueden colocar 2 electrones
-En el orbital p se pueden colocar 6 electrones
-En el orbital d se pueden colocar 10 electrones
-En el orbital f se pueden colocar 14 electrones
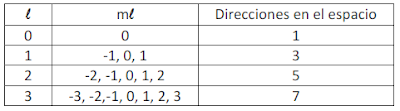
Número cuántico magnético (ml)
Este define la orientación espacial del orbital con respecto a un conjunto de ejes de coordenadas estándar.
Toma valores enteros, negativos y positivos. Estos van desde -l hasta +l.
Número cuántico Spin (s) también como (ms)
Este se refiere al giro del electrón en torno a su eje de rotación. El electrón, al girar, genera un campo magnético, y se comporta como un pequeño imán. A este movimiento se le asignan dos valores, - 1/2 y +1/2, que representan un giro hacia la izquierda y hacia la derecha de dicho eje.
Como hay sólo dos posibilidades de giro, en cada orbital deben existir como máximo 2 electrones de distinto spin (antiparalelos).
Para ubicar los electrones en los orbitales se acostumbra a representar al electrón de menor energía como a aquel tiene valor +½.
Principio de Hund: Los electrones se ubican en cada uno de los orbitales, con el spin de menor energía, y una vez que todos los orbitales contienen el electrón de menor energía, se aparean con el electrón de spin contrario.
Principio de Pauli: En un átomo no pueden existir dos electrones con sus 4 números cuánticos iguales.
Principio de Aufbau: Los electrones en el átomo se ubican primero en los orbitales de menor energía,
mientras que los orbitales de mayor energía solo se ocupan cuando se completa la capacidad de los de menor energía.
Cada orbital tiene un valor correspondiente a l
-El orbital s tiene un valor de l = 0
-El orbital p tiene un valor de l = 1
-El orbital d tiene un valor de l = 2
-El orbital tiene un valor de l = 3
Para escribir la configuración electrónica de un elemento, debemos ser el siguiente para colocar los electrones (de menor a mayor energía).
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s
Lo anterior es posible resumirlo en el siguiente esquema, en donde sólo hay que seguir la dirección de la flecha.
Es la descripción de la forma en que los orbitales de un átomo están ocupados por sus electrones. En cuanto al orden de llenado, de los orbitales se rige por el principio de Aufbau (construcción, en Alemán).
Este principio dice que el llenado se comienza por los de menor energía. Además, que un orbital solo puede tener dos electrones con spines opuestos (- 1/2 y +1/2), cumpliendo con el principio de exclusión de Pauli (en un átomo no puede haber dos electrones con los mismos números cuánticos).
Si hay disponibles dos o más orbitales de la misma energía (orbitales degenerados), los electrones se colocan de uno en uno hasta que todos queden semillenos. Sólo entonces un segundo electrón llena cada uno de los orbitales (regla de Hund).
Existe otra forma de nombrar la configuración, y es reemplazar él último nivel completo de un átomo por el gas noble inmediatamente ante, y esto encerrado en corchete:
Por ejemplo para el K (Z= 19)
1s2 2s2 2p6 3s2 3p5 (Forma desarrollada)
El último nivel completo lo reemplazamos por el gas noble que se encuentre antes del Potasio, que sería el Argón, y me quedaría así:
[Ar] 3p5 (Forma condensada o simplificada)
Otra manera de armar la configuración electrónica de un elementos es a través de las consecutivas formas de los gases nobles o inertes que se encuentran con la configuración electrónica completa (regla del octeto).
Actividad: realizar la configuración electrónica de los siguientes elementos químicos.
Al (Z= 13)
Ag (Z= 47)
Sr (Z=38)







No hay comentarios:
Publicar un comentario