En la tierra, la materia puede presentarse en tres estados: sólido, líquido y gaseoso. Sin embargo, en el conjunto del universo la mayor parte de la materia se encuentra como plasma (gas totalmente ionizado), estado en que también se halla el combustible en los reactores experimentales de fusión.
Los estados de agregación de las sustancias dependen de muchos factores, entre ellos, los tipos de uniones químicas que se establecen entre las moléculas también llamada naturaleza química, también están las condiciones de presión y temperatura normales (1 atm de presión y 273 K de temperatura). No es lo mismo decir los estados normales que las condiciones ambientales de acuerdo a la ubicación geográfica en la que se encuentran. Por ejemplo, el agua tiene un punto de fusión de 0 ° C (En regiones donde las temperaturas son inferiores a esta es común encontrar el agua en estado sólido o hielo). En cambio, en zonas donde hay actividad volcánica y las temperaturas se encuentran por encima de los 100 °C esta entra en ebullición y pasan al estado de vapor. Por otro lado, la presión atmosférica es una condición que también puede variar el estado de diferentes sustancias.
ESTADO GASEOSO
-Son fluidos porque se pueden desplazar sobre una superficie o escapar hacia el aire en todas las direcciones como el caso de los gases.
-No tienen forma definida sino que adoptan la forma del recipiente que los contiene, ni volumen definido sino que tienden a ocupar todo el espacio disponible.
-Estas partículas que tienen tanto movimiento, tanta energía cinética impide que se atraigan entre sí.
-Son compresibles, disminuyen su volumen fácilmente por efecto de la presión que se ejerce sobre ellos o por disminución de la temperatura.
-Son expansibles, aumentan su volumen por aumento de la temperatura o disminución de la presión.
-Son elásticos, una vez que cesa la causa que los comprime o expande tienden a recuperar sus dimensiones originales.
-Tienen densidades bajas, si consideramos la misma masa de un sólido, un líquido y un gas, esta última ocupará mucho más.
-Por lo tanto, su densidad será más baja. Se difunden, atraviesan materiales porosos y se mezclan con otros gases de manera espontánea y completa unos con otros.
ESTADO LÍQUIDO
-No tienen forma definida y adoptan la forma del recipiente que los contienen. Pero, a diferencia de los gases, conservan su volumen (en condiciones de presión y temperatura constantes).
-Al igual que los gases, estos son fluidos, pero no todos lo hacen con la misma velocidad. Una medida de la resistencia al flujo es la viscosidad. La miel, por ejemplo, fluye más lentamente que el agua. Decimos entonces que es más viscosa.
-En la mayoría de los casos, una sustancia en estado líquido tiene menor densidad que en estado sólido, salvo en el caso del agua, donde la densidad es mayor.
-Son prácticamente incompresibles. Una consecuencia de la incompresibilidad de los líquidos y su incapacidad para soportar fuerzas es que trasmiten la presión en todas direcciones.
-Tienen la propiedad de capilaridad, que es la posibilidad que tiene un líquido de ascender por un tubo delgado en contra de la gravedad.
-Por lo general, se expanden cuando se incrementa su temperatura y se comprimen cuando se enfrían.
-Los objetos inmersos en algún líquido son sujetos a un fenómeno conocido como flotabilidad.
ESTADO SÓLIDO
-Tienen forma propia y volumen definido.
-No son compresibles y no fluyen.
-La masa correspondiente a un determinado volumen es elevada a su densidad. El sólido más denso conocido es el Osmio (Os) que tiene una densidad de 22,6 g/ml. El más liviano es un material artificial llamado aerogel, cuya densidad es de 1 mg/ml.
-La mayoría de los sólidos están constituidos por átomos o iones que se ubican formando un modelo tridimensional llamado estructura cristalina, por eso los sólidos, como los minerales y los metales, también son llamados cristales. En los cristales los átomos están dispuestos formando una estructura geométrica tridimensional determinada, donde existe una celda unitaria, que es la unidad básica repetitiva de disposición de partículas que constituyen el cristal.
-Los sólidos que no tienen una estructura cristalina se llaman amorfos. Los vidrios son sólidos amorfos, ya que al calentarse se ablandan y gradualmente se transforman en líquidos. Es este caso no existe un cambio de fase de solido a liquido como sucede en los cristales, a una temperatura dada.
Los cambios de estados se dan de la siguiente manera:
A parte de los clásicos estados de agregación más comunes y conocidos se encuentran otros de los cuales se conocen de forma teórica. Estos son:
ESTADO DE PLASMA
Es también conocido como el cuarto estado de la materia. Es un estado fluido similar al estado gaseoso pero en el que determinada proporción de sus partículas, están cargadas eléctricamente (ionizadas) y no poseen equilibrio electromagnético (equilibrio de cargas), por eso son buenos conductores eléctricos y sus partículas responden fuertemente a las interacciones electromagnéticas de largo alcance.1 En cierta forma y de manera sintética, el plasma se puede caracterizar como un gas ionizado.
ESTADO DE PLASMA
Es también conocido como el cuarto estado de la materia. Es un estado fluido similar al estado gaseoso pero en el que determinada proporción de sus partículas, están cargadas eléctricamente (ionizadas) y no poseen equilibrio electromagnético (equilibrio de cargas), por eso son buenos conductores eléctricos y sus partículas responden fuertemente a las interacciones electromagnéticas de largo alcance.1 En cierta forma y de manera sintética, el plasma se puede caracterizar como un gas ionizado.
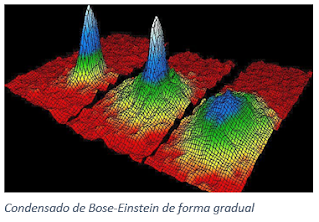
CONDENSADO DE BOSE-EINSTEIN
En física, el condensado de Bose-Einstein es el estado de la materia que se da en ciertos materiales a temperaturas cercanas a 0 K (Cero Kelvin o también llamado el Cero Absoluto donde se cree que la materia pierde totalmente el movimiento o energía cinética de sus partículas) La propiedad que lo caracteriza es que una cantidad macroscópica de las partículas del material pasan al nivel de mínima energía, denominado estado fundamental. El condensado es una propiedad que no tiene relación con los estados clásicos. Todas aquellas partículas que se han enfriado son fermiones, y lo que se encuentra es un líquido de Fermi.
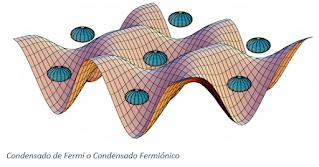
CONDENSADO DE FERMI
El condensado fermiónico es un estado de agregación de la materia en el que la materia adquiere superfluidez. Se produce a temperaturas muy bajas, cercanas al cero absoluto. Fue creado en la Universidad de Colorado por primera vez en 1999; el primer condensado de Fermi formado por átomos fue creado en 2003.








No hay comentarios:
Publicar un comentario