En las formulas de Lewis, o representaciones de puntos de Lewis es un método gráfico para observas los enlaces que se forman además de los electrones de la ultima capa que no intervienen.
"...en los elementos de los grupos A, el número de electrones de valencia (puentes en las formulas de Lewis) del átomo neutro es igual al número de grupo. Excepto del He ( 2 electrones)..."
En este caso, los elementos representativos adquieren la configuración del gas noble más cercano en casi todos sus compuestos (Hay varias excepciones).
C = N - D
Donde C, es el número de electrones compartidos de la molécula o ión poliatomico. Se reconoce a la N, como el número de electrones necesarios de valencia para completar el octeto (Voy a considerar 8 electrones por cada átomo a excepción del Hidrógeno que consideraré 2 electrones debido a que el gas noble más próximo es el He). Y finalmente, a D, serán los números de electrones disponibles de la capa de valencia de todos los átomos del Bloque s y p (Elementos representativos que se ven en la imágen de arriba en este Post).
Tomando como ejemplo, utilizaremos esto para definir la estructura de Lewis para el Dioxido de Carbono.
En otro caso, tomando como ejemplo al agua para definir la estructura de Lewis sería:


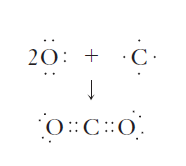

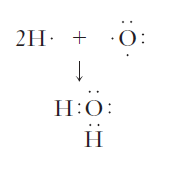
No hay comentarios:
Publicar un comentario